高中化学常考知识点:硝酸(HNO3)
来源:高考网整理 2022-08-25 11:24:54
(1)硝酸物理性质:纯硝酸是无色、有刺激性气味的油状液体。低沸点(83℃)、易挥发,在空气中遇水蒸气呈白雾状。98%以上的硝酸叫“发烟硝酸”,常用浓硝酸的质量分数为69%。
(2)硝酸的化学性质:具有一般酸的通性,稀硝酸遇紫色石蕊试液变红色,浓硝酸遇紫色石蕊试液先变红(H+作用)后褪色(浓硝酸的强氧化性)。用此实验可证明浓硝酸的氧化性比稀硝酸强。浓硝酸和稀硝酸都是强氧化剂,能氧化大多数金属,但不放出氢气,通常浓硝酸产生NO2,稀硝酸产生NO,如:
①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
反应①还原剂与氧化剂物质的量之比为1︰2;反应②还原剂与氧化剂物质的量之比为3︰2。
常温下,Fe、Al遇浓H2SO4或浓HNO3发生钝化,(说成不反应是不妥的),加热时能发生反应:
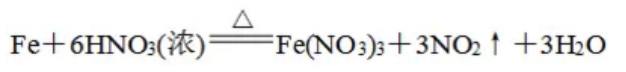
当溶液中有H+和NO3-时,相当于溶液中含HNO3,此时,因为硝酸具有强氧化性,使得在酸性条件下NO3-与具有强还原性的离子如S2-、Fe2+、SO32-、I-、Br-(通常是这几种)因发生氧化还原反应而不能大量共存。(有沉淀、气体、难电离物生成是因发生复分解反应而不能大量共存。)
相关推荐:
最新高考资讯、高考政策、考前准备、志愿填报、录取分数线等
高考时间线的全部重要节点
尽在"高考网"微信公众号

相关推荐
高考院校库(挑大学·选专业,一步到位!)
高校分数线
专业分数线
- 日期查询


