高考化学冲刺,化学反应速率知识总结
2018-12-28 21:31:34三好网
一、化学反应速率
1.表示方法
通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
2.数学表达式及单位

3.规律
同一反应在同一时间内,用不同物质来表示的反应速率可能不同,但反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比。
4.注意事项
(1)描述反应速率时应指明具体物质。
(2)一般来说,化学反应速率随反应的进行而逐渐减慢。某一段时间内的反应速率,实际上是一段时间内的平均速率,而不是指瞬时速率。
(3)无论是反应物还是生成物,其化学反应速率值都取正值。
(4)由于一个化学反应里各物质之间化学计量数不一定相同,所以,在同一个化学反应里,用不同物质表示的化学反应速率不一定相同。但是,各物质的化学反应速率之比等于它们的化学计量数之比。
(5)固体或纯液体(注意:不是溶液)的物质的量浓度可视为不变的常数,一般不用于表示化学反应速率。
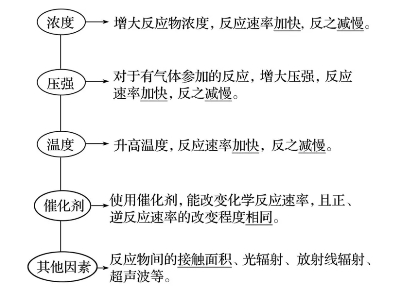
二、影响化学反应速率的因素
1.内因(主要因素)
反应物本身的性质。
2.外因(其他条件不变,只改变一个条件)
三、有效碰撞理论
1.活化分子、活化能、有效碰撞
(1)活化分子
能够发生有效碰撞的分子。
(2)活化能
活化分子比普通分子所高出的能量。活化能越小,普通分子就越容易变成活化分子。(如图)
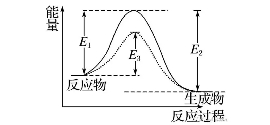
图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能)
(3)有效碰撞
活化分子之间能够引发化学反应的碰撞。
(4)活化能与化学反应速率的关系
在一定条件下,活化分子所占的百分数是固定不变的。活化分子的百分数越大,单位体积内活化分子数越多,单位时间内有效碰撞的次数越多,化学反应速率越快。
2.活化分子、有效碰撞与反应速率的关系
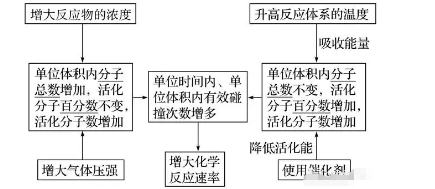
气体反应体系中充入惰性气体(不参与反应)时对反应速率的影响
(1)恒容
充入“惰性气体”―→总压增大―→物质浓度不变(活化分子浓度不变)―→反应速率不变。
(2)恒压
充入“惰性气体”―→体积增大―→物质浓度减小(活化分子浓度减小)―→反应速率减小。
三、解题贴士
1.计算速率时易忽略体积,用物质的量变化值除以时间。
2.化学反应速率大小的比较方法
由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化。
(1)看单位是否统一,若不统一,换算成相同的单位。
(2)换算成同一物质表示的速率,再比较数值的大小。
(3)比较化学反应速率与化学计量数的比值。
3.对于较为复杂的关于反应速率的题目(“三段式”法)
(1)写出有关反应的化学方程式。
(2)找出各物质的起始量、转化量、某时刻量。
(3)根据已知条件列方程式计算。















